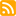802
802
 0
0
Nitơ
1. Vị trí và cấu hình electron nguyên tử
- Cấu hình e: 1s2 2s2 2p3
- Chu kì 3, nhóm VA
- Cấu tạo phân tử N ≡ N
- Công thức phân tử: N2
-Độ âm điện: 3, 04 chỉ kém oxi và flo
- Số oxi hóa: -3;+1;+2;+3;+4;+5
2. Tính chất vật lý và tính chất hóa học
- Tính chất vật lý
+ Là chất khí không độc, ít tan trong nước
+Không duy trì sự cháy, sự hô hấp
- TÍnh chất hóa học
+ Các mức oxi hóa-khử: -3 ; +1, +2, +3, +4, +5
OXH
Khử
Liên kết ba trong phân tử N2 bền nên ở điều kiện thường N2 trơ về mặt hóa học, chỉ phản ứng khi có nhiệt độ trên 3000 độ C.
+ Tính oxi hóa
* Tác dung với kim loại: Tác dụng với kim loại mạnh tạo muối nitrua kim loại
2Al + N2 → 2AlN
3Ca + N2 → Ca3N2
* Tác dụng với H2:
N2 + 3H2 ↔ 2NH3 (> 400 độ C; Fe, p) ; ΔH = -92kJ
+ Tính khử
N2 + O2 ↔ 2NO (Phản ứng xảy ra ở nhiệt độ 30000C hoặc có tia lửa điện)
2NO + O2 → 2NO2
(khí không màu) (khí màu nâu đỏ)
3. Ứng dụng
- Là thành phần dinh dưỡng chính của thực vật
- Sản xuất axit nitric, phân đạm
- Sử dụng làm môi trường trơ
- Dùng để bảo quản máu và các mẫu vật sinh học
4. Trạng thái tự nhiên
- Dạng tự do
Khí nitơ chiếm 78, 16% thể tích không khí
- Dạng hợp chất
Khí nitơ có nhiều trong khoáng chất NaNO3 với tên gọi là diêm tiêu. Nitơ còn có trong thành phần của protein động vật và thực vật
5. Điều chế
- Trong công nghiệp
+ Sử dụng phương pháp chưng cất phân đoạn không khí lỏng để thu được khí nitơ. Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm
- Trong phòng thí nghiệm
Nhiệt phân muối amoni nitrit
NH4NO2 → N2 + 2H2O (t0)
NH4Cl + NaNO2 → N2 + NaCl + 2H2O (t0)
1. Vị trí và cấu hình electron nguyên tử
- Cấu hình e: 1s2 2s2 2p3
- Chu kì 3, nhóm VA
- Cấu tạo phân tử N ≡ N
- Công thức phân tử: N2
-Độ âm điện: 3, 04 chỉ kém oxi và flo
- Số oxi hóa: -3;+1;+2;+3;+4;+5
2. Tính chất vật lý và tính chất hóa học
- Tính chất vật lý
+ Là chất khí không độc, ít tan trong nước
+Không duy trì sự cháy, sự hô hấp
- TÍnh chất hóa học
+ Các mức oxi hóa-khử: -3 ; +1, +2, +3, +4, +5
OXH
Khử
Liên kết ba trong phân tử N2 bền nên ở điều kiện thường N2 trơ về mặt hóa học, chỉ phản ứng khi có nhiệt độ trên 3000 độ C.
+ Tính oxi hóa
* Tác dung với kim loại: Tác dụng với kim loại mạnh tạo muối nitrua kim loại
2Al + N2 → 2AlN
3Ca + N2 → Ca3N2
* Tác dụng với H2:
N2 + 3H2 ↔ 2NH3 (> 400 độ C; Fe, p) ; ΔH = -92kJ
+ Tính khử
N2 + O2 ↔ 2NO (Phản ứng xảy ra ở nhiệt độ 30000C hoặc có tia lửa điện)
2NO + O2 → 2NO2
(khí không màu) (khí màu nâu đỏ)
3. Ứng dụng
- Là thành phần dinh dưỡng chính của thực vật
- Sản xuất axit nitric, phân đạm
- Sử dụng làm môi trường trơ
- Dùng để bảo quản máu và các mẫu vật sinh học
4. Trạng thái tự nhiên
- Dạng tự do
Khí nitơ chiếm 78, 16% thể tích không khí
- Dạng hợp chất
Khí nitơ có nhiều trong khoáng chất NaNO3 với tên gọi là diêm tiêu. Nitơ còn có trong thành phần của protein động vật và thực vật
5. Điều chế
- Trong công nghiệp
+ Sử dụng phương pháp chưng cất phân đoạn không khí lỏng để thu được khí nitơ. Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm
- Trong phòng thí nghiệm
Nhiệt phân muối amoni nitrit
NH4NO2 → N2 + 2H2O (t0)
NH4Cl + NaNO2 → N2 + NaCl + 2H2O (t0)